Undersea explorer Victor Vescovo
月度归档: 2019 年 8 月
自噬与骨质疏松
山东体育学院研究生教育学院 郭健民 周林 章岚
随着人口的老龄化,骨质疏松已成为亟待解决的全球公共健康问题,其主要特征是骨量减少、骨微结构损伤,导致骨强度降低和脆性增加,使骨折发生风险升高。骨量和骨微结构的保持依赖于成骨细胞和破骨细胞功能的动态平衡。人体内的激素、生长因子以及生物活性物质都参与维持骨微环境的平衡。此外,遗传、营养、机械应力、神经调节、自噬、氧化应激等因素也被作为影响骨微环境稳态的研究热点。而自噬作为细胞适应应激环境的主要调节方式,在骨代谢中发挥重要的调控作用。在基础条件下,自噬是细胞存活的重要机制,但当自噬不足时,受损的蛋白质和细胞器会在细胞内累积,加速细胞凋亡的发生;相反,如果自噬被过度激活,细胞器和蛋白质的降解超过一定限度时,同样会诱发细胞凋亡。研究证实,自噬与骨质疏松等骨代谢疾病的发病机制存在一定的关联。
1 自噬的过程
自噬是高度保守的细胞分解代谢和能量产生的过程,可在溶酶体中批量降解、回收细胞内的细胞器、蛋白质和致病性微生物。根据细胞的功能和细胞质运输的形式可将自噬分为 3 类:大自噬、小自噬和分子伴侣自噬。通常所说的自噬是指大自噬,即由内质网来源的膜包绕待降解物形成自噬体,然后与溶酶体融合并降解其内容物。本文主要综述大自噬与骨质疏松发生发展进程相关的研究。
自噬的起始步骤是自噬小泡的形成,其受到自噬相关基因 (autophagy-related gene, ATG)家族蛋白的调控,迄今为止已有超过 30 种 ATGs 被发现。自噬小泡的形成通过隔离膜的出现而启动,隔离膜可能来源于内质网、线粒体、高尔基复合体和质膜等细胞器。在这个阶段,III级 PI3K/Vps34 (vacuolar protein sorting 34)复合体被激活,进而与 Beclin-1、 Atg14、Vps15 形成多蛋白复合体,促进吞噬泡的形成和 ATG 蛋白的募集。随后,隔离膜拉长变成球形,并不断扩大形成一个密封的双层膜结构,这个过程受两个保守的共轭系统调控。其中一个是由 Atg12 和 Atg5 缀合组成,这一过程与 Atg7 和 Atg10 协作相关联。另一个是在 Atg4、Atg7 和 Atg3 帮助下, PE (phosphatidyle-thanolamine)和 Atg8/LC3 (microtubule associated protein 1A/1B light chain 3)缀合。LC3-II是预测自噬体形成的可靠蛋白质标记物,其合成过程中主要包含 3 种重要形式:未加工形式 (pro-LC3)、蛋白质水解加工形式 (LC3-I)和 PE-共轭形式 (LC3-II)。随后,溶酶体和自噬体外膜融合形成自噬溶酶体,隔离的材料和内部的自噬体膜被分解并降解。
自噬是调节细胞和生物组分的合成、降解、再循环所必需的,如氨基酸的回收再利用和受损细胞器的移除。适宜的自噬水平对于保护细胞器和蛋白质的完整性起决定性作用;相反,不受限制的自噬可能会诱导细胞的程序性死亡,因为高水平的自噬会导致细胞质蛋白和细胞器的过度降解,使细胞功能受到严重影响。
2 骨质疏松的诱发
骨骼的动态平衡由成骨细胞、破骨细胞、骨髓间充质干细胞 (bone marrow mesenchymal stem cells, BMSCs)等细胞共同维持,骨代谢平衡的失调会引起骨质疏松、骨关节炎等疾病。雌激素缺乏、长期使用糖皮质激素、缺乏机械刺激、氧化应激等因素均会诱发骨质疏松。骨细胞表面有很多性激素受体,雌激素可促进成骨分化,抑制骨吸收,但在老年女性人群中由于雌激素水平的下降,骨转换速率增加,骨吸收增加,从而造成骨量和骨密度的下降。长时间接触糖皮质激素,会使成骨细胞生成减少,诱导成骨细胞和骨细胞凋亡,延长破骨细胞的寿命,使骨量减少和骨强度降低,最终诱发骨质疏松。氧化应激是指组织或细胞内由于活性氧 (reactive oxygen species, ROS)的过量生产或清除障碍,导致活性氧 ROS 的水平增加,其与衰老、癌症和糖尿病密切相关。氧化应激会引起细胞的一系列变化,如激活凋亡信号通路、导致细胞功能障碍等,并以此参与绝经后骨质疏松、糖皮质激素诱导的骨质疏松和老年性骨质疏松等不同类型骨质疏松的病理过程。机械应力刺激可促进 BMSCs 向成骨分化,而长时间的卧床、悬吊等导致机械刺激减少,骨生成下降,最终导致骨质疏松症发生。在各种因素诱发骨质疏松的过程中,自噬对骨细胞的功能代谢会产生一定的调控作用,这为临床骨质疏松的治疗提供了潜在的靶点。
3 自噬与骨细胞
3.1 自噬和破骨细胞
破骨细胞的主要功能是骨吸收,它起源于造血干细胞并受 RANKL (receptor activator for nuclear factor-κB ligand)和 M-CSF (macrophage colony-stimulating factor)的调控,破骨细胞中的降解酶和质子被转运到褶皱处的基底外侧膜,进而溶解矿物质并使骨基质脱钙。自噬对于保持破骨细胞正常生理功能以及促进破骨前体细胞向破骨细胞分化具有重要意义,自噬抑制会使破骨前体细胞向破骨细胞分化减少,同时,也会造成破骨细胞功能障碍。Chung 等研究发现, Beclin-1 是骨髓巨噬细胞向破骨细胞分化必不可少的,在骨髓巨噬细胞中敲低 Beclin-1 后, NATc1 (nuclear factor of activated T cells 1)的表达和破骨细胞的生成都显著减少,其可能机制是抑制了 JNK 和 p38 的活化。 P62 在自噬过程中被整合到自噬体中而被降解,是常用的自噬通量标记物。在破骨细胞中,使用 siRNA 抑制 P62 的表达后,TRAP (tartrate-resist-ant acid phosphatase)阳性多核细胞的数量显著减少,同时,与破骨细胞生成相关的基因 TRAP、NFATc1、CatK (cathepsin K)、Fra-2 等的表达均显著下降。在破骨细胞发挥功能的过程中,褶皱边界的形成需要突触结合蛋白 VII 和 Rab7。 Deselm 等研究发现,在小鼠单核细胞中敲除 ATG5 可以使小鼠的骨量显著增加,破骨细胞的数量显著减少,且 ATG 介导了 Rab7 的募集。综合上述研究发现,Beclin-1、P62、ATG5、LC3 等自噬相关基因都是维持破骨细胞分化和正常生理功能必不可少的。
除了维持破骨细胞的生理功能外,自噬在氧化应激、接触糖皮质激素和微重力等条件下,可促进破骨细胞的形成 (图 1)。Shi 等研究发现,地塞米松暴露可以使小鼠的骨量减少,使用 1 μmol/L 的地塞米松干预破骨细胞后,可显著增加破骨细胞中 RANK (receptor activator for nuclear factor κB)、TRAP、 CTSK 的表达,并诱导破骨细胞自噬和氧化应激;而使用 3-MA (3-methyladenine)抑制破骨细胞自噬后,破骨细胞形成和功能均受到抑制,这表明在地塞米松干预下自噬可促进破骨细胞的形成。在小鼠单核细胞中敲除 ATG7 或使用 CQ (chloroquine)抑制自噬,可以有效地抑制地塞米松或卵巢去除诱导的小鼠骨量丢失;体外细胞实验也发现,使用 CQ 抑制成骨细胞自噬后, RANKL 的分泌显著减少,而破骨细胞自噬被抑制后,NFATc1、OSCAR、 TRAP、CatK 等的表达也显著降低,表明在骨质疏松中,自噬可能会诱导破骨细胞的分化和形成。另一项研究也发现,在巨噬细胞 RAW264.7 中, DOT1L (disruptor of telomeric silencing 1-like)抑制剂会显著增加破骨细胞的自噬水平,而抑制 DOT1L 在去卵巢小鼠中的表达后,会促进破骨细胞的融合,加剧骨量的丢失,这也说明在骨质疏松中高水平的自噬与骨丢失密切相关。
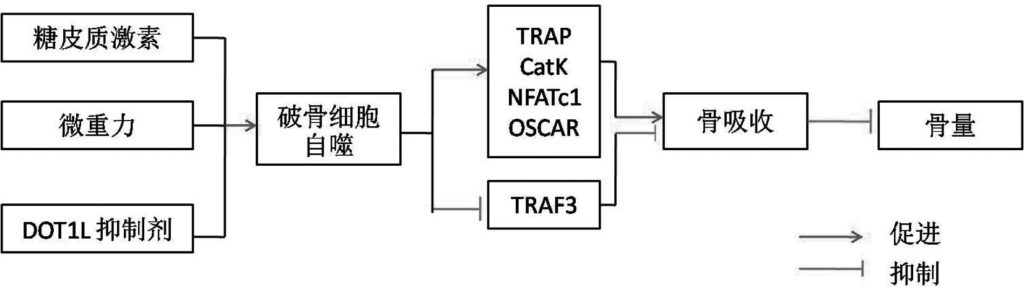
微重力环境下,骨受到的机械刺激减少,骨吸收大大增加。Sambandama等的研究发现,在微重力环境下自噬介导了破骨细胞的形成。他们发现,在微重力环境下,小鼠破骨前体细胞的自噬水平显著增高,其中 ATG5 和 LC3 mRNA 的表达分别增加了 20 倍和 35 倍,同时 ATG5 和 LC3-II 蛋白的表达水平也分别提高了 8 倍和 7 倍,破骨分化相关的基因 TRAP、CatK 的表达也都显著增加,而使用 3-MA 抑制自噬后,有效地逆转了微重力对破骨细胞分化的影响。此外,在破骨细胞中敲除 ATG5 会导致小鼠骨量增加,并减少了卵巢去除诱导的骨丢失。这表明自噬与机械刺激减少、雌激素缺乏导致的骨流失存在关联。
目前关于自噬调控破骨细胞形成和分化机制的研究还较少,除了上述文献中报道的自噬可调控 NFATc1、OSCAR、TRAP、CatK 等破骨分化相关基因外,有研究发现,自噬可通过调控 TRAF3 (TNF receptor-associated receptor 3)来影响破骨细胞分化。 TRAF3 可抑制破骨细胞的分化,抑制去卵巢小鼠中自噬可以增加 TRAF3 的表达,进而抑制破骨细胞的成熟,这表明在骨质疏松中自噬诱导 TRAF3 的降解对于破骨细胞的成熟很重要。Cdc42 可以调控骨髓巨噬细胞的增殖和破骨细胞的生存、分化、极化。Chung 等研究发现, LC3 缺失没有影响 TRAP 阳性多核细胞的形成,但抑制了 CTSK 的释放和破骨细胞的活性,其可能的机制是 LC3 影响了 Cdc42 的活性。
3.2 自噬和成骨细胞
自噬对于维持成骨细胞的正常生理功能至关重要。ATG5 作为自噬和凋亡的开关,在自噬的发生发展中起着重要的调节作用。在自噬空泡形成的早期阶段,由 ATG12-ATG5-ATG16 组成的复合物与自噬空泡的外膜相结合,促进自噬泡的膨胀和 LC3 向自噬空泡的移动。Weng 等研究发现,在成骨细胞中抑制 ATG5 的表达后,成骨细胞的增殖和分化均受到抑制,而过表达 ATG5 并不对成骨细胞的增殖和分化产生显著影响,但可以抑制氧化应激诱导的细胞凋亡。此外,在小鼠成骨细胞中敲除 ATG7 会使其骨自噬水平下降,同时引起内质网应激,使小鼠成骨分化标志物 ALP (alkaline phosphatase)、 Runx2 (runt-related transcription factor 2)等的表达减少,成骨细胞的生成和骨基质的矿化减少,细胞凋亡增加,这表明自噬对于维持成骨细胞正常的功能、活性是不可或缺的。
自噬介导成骨前体细胞向成骨细胞分化的过程,已有研究表明自噬参与保持 BMSCs 的干细胞性状,并可通过 AMPK/Akt/mTOR 信号通路调节 BMSCs 向成骨细胞分化。抑制自噬会造成 ROS 累积和 DNA 损伤,而在 MSC 中 ROS 诱导的自噬可通过激活 JNK 抵抗细胞凋亡。因此,自噬可通过预防 ROS 诱导的细胞凋亡,延长 MSC 的存活。Qi 等研究发现,使用 siRNA 抑制小鼠 BMSCs 中 ATG5/Beclin-1 的表达后,细胞自噬水平显著降低,同时,细胞钙化结节的数量显著减少,而脂滴形成增加,这表明自噬参与 BMSCs 的分化过程。此外,该研究还发现在去卵巢小鼠 BMSCs 和骨髓中自噬水平均显著下降,用雷帕霉素干预去卵巢小鼠一个月后,小鼠的骨量和骨密度均显著增加;体外实验发现,使用雷帕霉素激活去卵巢小鼠 BMSCs 自噬后,其成骨分化标志物 Runx2 和 ALP 的表达显著增加,这表明自噬可能通过上调相关基因的表达,参与调控 BMSCs 向成骨细胞分化的过程。
在后肢悬吊引起的废用性骨质疏松小鼠模型中,使用 3 mg/kg/d 的雷帕霉素干预 4 周后发现,小鼠的自噬被显著激活,并且其骨量、骨小梁数量、骨小梁厚度均显著增加,而其骨小梁分离度显著降低,同时,小鼠成骨细胞中成骨分化因子 Runx2 的表达增加,这表明在骨质疏松中自噬可通过促进成骨细胞分化使骨生成增加。在泼尼松龙诱导的大鼠骨质疏松模型中,大鼠的骨量、骨密度和自噬水平均显著下降,同时,骨细胞中成骨分化标志物 Runx2、RANKL 和 BMP2 的表达也都显著减少,使用 β-蜕皮甾酮进行干预后,骨质疏松大鼠骨的自噬水平升高,同时,逆转了泼尼松龙诱导的骨量减少,这表明糖皮质激素可能通过下调自噬抑制成骨分化,并使骨量减少。有研究发现,在正常情况下激活或抑制自噬对成骨细胞的活性没有显著影响,但在低剂量的地塞米松干预下,成骨细胞自噬水平和细胞活性显著升高,此时使用 3-MA 抑制自噬后,细胞活性和成骨分化标志物 Runx2 和 OCN 等的表达均显著降低。在较高剂量的地塞米松干预下,成骨细胞自噬水平升高,细胞活性和分化均受到抑制,细胞凋亡增加,抑制自噬后,则有效逆转了高剂量的地塞米松对成骨的损害作用。长时间使用糖皮质激素可诱发骨质疏松,其主要原因可能是糖皮质激素使成骨细胞的自噬过度激活,导致成骨细胞活性下降、凋亡增加、功能受损。
自噬是一把双刃剑,在不同的生理或病理情况下其发挥的功能各不相同。正常的生理情况下,自噬对于保持成骨细胞的生理功能是必不可少的,但在糖皮质激素暴露、缺少机械刺激的情况下,自噬被抑制或过度激活,此时自噬对成骨细胞的功能、活性产生不利影响,从而加剧了骨质疏松发生的可能。
3.3 自噬与骨细胞
骨细胞通过分泌 PGE2 (prostaglandin E2)、IGF1 (insulin-like growth factor 1)、SOST (sclerostin)、DKK1 (dickkopf-related protein 1)等来调控成骨细胞,也可通过分泌 OPG (osteoprotegerin)、TGF-β(transforming growth factor-beta)、RANKL 来调控破骨细胞。抑制骨细胞自噬后, LC3、Beclin-1 的表达减少,同时, SQSTM1/p62 的表达和细胞凋亡增加,这表明抑制骨细胞自噬可能会导致老年化相关的骨质疏松。也有研究发现,在雌性小鼠骨细胞中敲除 ATG7 后,小鼠的骨量下降。在去卵巢大鼠模型中,ROS 可以刺激骨细胞自噬,而衰老相关的骨量丢失会导致自噬水平的下降,进而引起氧化应激。这表明衰老导致的骨丢失伴随着 ROS 的增加,但其作用机制尚不明确。
Xia 等的研究发现,使用 10⁶ mol/L 的地塞米松干预成骨细胞 24 h 后,其自噬标志物 LC3 的表达显著增加。抑制自噬和使用糖皮激素都会使骨细胞的数量显著减少,但抑制自噬对骨细胞的作用大于糖皮质激素使用。糖皮质激素的剂量对骨细胞的命运有决定性作用,低剂量会导致骨细胞自噬,高剂量则会引起细胞凋亡。在小鼠骨细胞中敲除 ATG7 会使骨生成下降,而同时施加糖皮质激素干预,并不会加剧骨量的丢失。这表明糖皮质激素对骨细胞的影响可能通过自噬来实现,因此,可通过调节自噬抑制糖皮质激素诱导的骨细胞凋亡。
4 运动防治骨质疏松作用机制研究的新靶点
骨质疏松的常规药物治疗存在一定毒副作用,且加重了家庭和社会医疗系统的经济负担,而运动作为一种简便易行、经济有效的疗法,其在防治骨质疏松的中作用已得到广泛的证实。目前,关于运动防治骨质疏松的机制研究主要从机械应力、激素、细胞因子、骨代谢信号通路以及非编码 RNA 等方面进行。最新研究发现,自噬可能也介导了运动防治骨质疏松的过程。 2018年,Zhou 等研究发现,流体剪切力可显著增加骨细胞的自噬,而使用 3-MA 抑制其自噬水平后,细胞的死亡率大大增加。此外, Inaba 等的研究也发现,循环机械应力刺激可激活骨细胞自噬,同时增加抗凋亡基因的表达,并有效减少细胞的死亡。骨细胞是机械刺激的主要传感器,而在老化的骨细胞中,自噬水平的减少往往伴随着细胞死亡的增加,这表明在老年人群中可通过给于机械刺激,增加骨细胞的自噬水平,从而使其死亡率减少。关于自噬是否介导运动对 BMSCs、成骨细胞和破骨细胞的影响,尚未见有相关的报道,这将是运动防治骨质疏松作用机制研究的新热点。笔者认为适宜的机械刺激可适度激活骨微环境中各种细胞的自噬,使其向有利于骨形成的方向发展,而过度的刺激有可能会从过度激活和抑制自噬两方面影响骨细胞的活性和功能。
5 小结
在雌激素缺乏、机械刺激减少、长期接触糖皮质激素、氧化应激等因素诱发骨质疏松的过程中,自噬水平产生变化,进而对成骨细胞、破骨细胞、 BMSCs、骨细胞功能活性产生影响,并以此参与骨质疏松的发展进程。未来,自噬有可能成为改善骨质疏松的潜在靶点,但在一系列的细胞微环境中,对不同自噬阶段的精确调控仍需要更多的研究,以将其应用于临床。同时,为了找到多样化的、创新性的治疗方法,对于骨质疏松的发病机制的研究也需要广大学者共同努力。此外,运动作为一种防治骨质疏松经济有效的方法,其对骨细胞自噬水平的影响以及自噬是否介导运动防治骨质疏松的作用及其相关机制都需要不断探索。
