月度归档: 2019 年 2 月
原位杂合技术 (In situ hybridization;ISH)
台湾大学生命科学所 霍其嵘
原位杂合(下简称为:ISH)是一种被广泛使用来确认组织及细胞中特定DNA或是RNA表现位置的方法。最早是由美国生物学家Mary-Lou Pardue跟Joseph G. Gall在1969年所发明的。当生物体的个体不是很大时,可以在不进行切片或是分离的状况下进行染色,这种做法称之为全标本包埋原位杂合(Whole – mount in situ hybridization, WISH)。
ISH的原理其实和南方墨点法(Southern blotting)类似,都是利用核酸序列会互补的特性来设计探针(probe)去标定互补(Complementary)DNA或RNA。 RNA探针必须要能够和生物体的RNA进行互补结合,所以使用的序列为反股RNA(antisense RNA),正股的探针因为和组织或是细胞内所含有的RNA相同,所以无法进行互补,故常被用来做为阴性对照组(Negative control)。
DNA或是RNA探针和序列互补结合之后,会利用抗体去辨识及呈色。为了要让抗体可以辨识部分核酸,杂合探针在制作的过程中,并不会使用一般聚合酶连锁(PCR)反应中使用的核糖核苷三磷酸(ribonucleoside triphosphate;rNTP),而是会使用具有放射性、萤光或是抗原标定过核糖核苷三磷酸。如:Digoxigenin标定的核糖核苷三磷酸(DIG-rNTP)为目前最常被使用的类型。
由于抗体本身无法呈色,所以一般呈色方法通常透过碱性磷酸酶(Alkaline phosphate)结合抗体进行染色。因为碱性磷酸酶的受质5-Bromo-4-chloro-3-indolyl phosphate(BCIP)会被环境中的氧气或是Nitro blue tetrazolium chloride (NBT)氧化,产生蓝色的沉淀物,所以可用来标示出探针和特定基因在组织或是细胞中结合的位置,也就是特定基因在组织或是个体表现的准确位置。这种方法被称为显色原位杂合技术(Chromogenic in situ hybridization, CISH)。若是在抗体上直接接上萤光素来标定,不需要酵素跟沉淀物的反应,则称之为萤光原位杂合技术(Fluorescence in situ hybridization, FISH)。
CISH的实验会依照使用的探针种类、呈色方法而有些许变化,但实验步骤大致如下:
- 首先要使用像是Protease K 的蛋白酶,去破坏细胞膜(cell membrane)让水溶性的探针可以进入胞内。
- 当探针通过细胞膜进入胞内之后,需要让探针和特定的DNA或是RNA进行杂合。这个步骤通常会在高温60-65℃ 的状况下进行。为了确保探针和DNA或RNA能顺利的进行结合,通常此步骤会持续进行12个小时以上。
- 杂合结束之后,再使用抗体去标定特定的探针。
- 最后在使用NBT/BCIP等碱性磷酸酶受质来呈色。
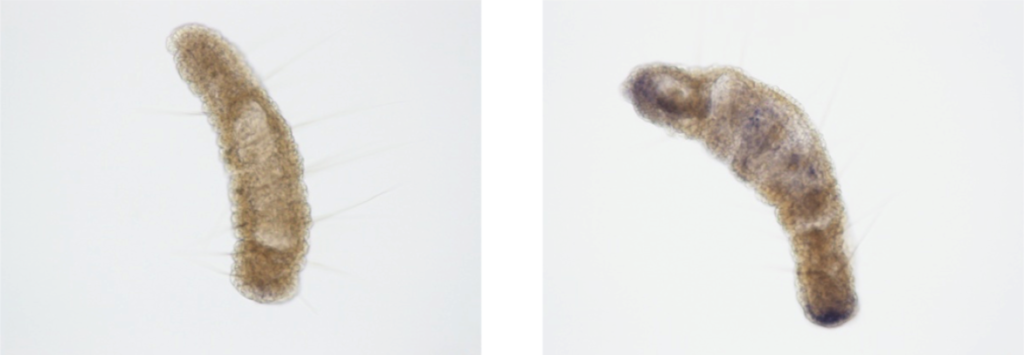
左图为正股(Sense)探针的控制组,右图为反股(Antisense)的实验组
基因治疗
基因治疗是当代医学和生物学的一个新的研究领域。最初的基因治疗是针对根治遗传病而提出的。现在基因治疗(gene therapy)是指能将正常的外源基因通过基因转移技术插入患者特定靶细胞中,取代患者受体细胞中的缺陷基因,最终达到纠正或补偿基因缺陷或异常的目的。基因治疗的内容包括基因诊断、基因分离、载体构建和基因转移。
基因治疗的分类
基因治疗包括靶细胞的选择和基因转移两个步骤。其中,靶细胞的选择依疾病种类而定,根据治疗基因导入病变细胞的类型不同,基因治疗可分为生殖细胞治疗和体细胞治疗等两种策略。将正常基因转入生殖细胞或胚胎细胞,有可能彻底阻断缺陷基因的纵向遗传,但此方法涉及伦理学和法学的问题,故目前开展的基因治疗均采用体细胞作为靶细胞,如骨髓干细胞、皮肤或纤维细胞、干细胞、血管内皮细胞和肌细胞等。肿瘤治疗常用的靶细胞是自身的肿瘤细胞和造血干细胞。
治疗方式
矫正性基因治疗
矫正性基因治疗包括基因置换(gene replacement)、基因矫正(gene correction)和基因增强(gene augmentation)3 种。基因置换是通过同源重组用正常基因替代突变基因;基因矫正是通过定点重组对突变基因的序列在原位进行特异的修复;基因增强是将正常功能的基因转移到有基因缺陷或基因丢失的细胞中,以表达正常产物,从而弥补缺陷基因的功能。理论上,基因置换和基因矫正是基因治疗的理想方法,但是由于技术上的限制,目前以基因增强为最常用的方式。基因增强最适合单基因隐性遗传病(recessive monogenic diseases)的治疗;对显性遗传疾病,这种方法的应用价值受到一定限制,因为不正常的基因产物可能影响细胞的功能;对于肿瘤和感染性疾病的基因治疗,也存在同样的问题,因此增补缺陷基因功能的同时,还要设法减少缺陷基因的表达或过度表达。
调控性基因治疗
调控性基因治疗是广义的基因治疗,它通过调控某些基因的表达来达到改善症状的目的
- 基因治疗的反义技术主要有 3 类:一类是将特异的反义基因重组到表达载体上,导入靶细胞后转录出反义 RNA,它与靶 RNA 结合形成双链,能封闭 mRNA 的翻译;第二类是人工合成反义寡聚脱氧核苷酸(oligodeoxynucleotide),经化学修饰后导入体内通过胞吞进入细胞后与 DNA 结合形成核苷酸三聚体,它能影响转录因子的结合,使转录不能启动,或者与 mRNA 结合形成 RNA-DNA 杂链,影响基因的翻译;第三类是核酶,即具有催化作用的 RNA 分子,能催化切割、降解异常表达基因的 RNA ,已设计出具有锤头(hammerhead)和发夹(hairpin)结构的特异性核酶。核酶介导的基因表达抑制的最大特点是其切割位点的特异性,切割位点的一个点突变就足以使核酶丧失切割能力。反义技术常用于肿瘤和病毒疾病的治疗中,其效果在很大程度上取决于是否能将反义核酸、核酶基因或寡聚脱氧核苷酸有效地导入细胞。
- 通过其他基因的代偿作用弥补缺陷基因的功能。
治疗途径
体细胞基因治疗有体内(in vivo)和体外(ex vivo)治疗之分。前者是借助于载体直接将正常基因导入患者的病变组织器官内,该方法比较适用于脏器性分子的治疗;后者则必须从机体内预先分离出病变的细胞,体外导入正常基因,经鉴定和扩增后再将这种转基因细胞回输入患者体内,此方法对血液和骨髓等流动系统病变较为适用。
在基因转移方面:
第一,原则上依据病因和发病机制进行治疗基因的选择。其来源有:① 供体细胞的基因组 DNA 或经限制性内切酶消化的 DNA 片段;② 分离得到的某一基因;③ 反转录法得到的基因;④ 人工合成的 DNA 片段。
第二,应用重组 DNA 技术,结合基因的研究成果,分离并克隆人类特异正常基因。
第三,基因转移(gene transfer)是指将外源目的基因导入靶细胞内并达到高效表达,基因转移的方法有化学法、物理法和生物法。化学法有磷酸盐沉淀、脂质体包裹、多聚季铵盐和 DEAE-葡萄糖等化学试剂转移,目的是通过改变细胞膜的通透性或提高 DNA 与细胞的吸附作用而实施基因转移。物理法包括电穿孔、显微注射、裸露 DNA 直接注射、颗粒轰击等实施基因转移。生物法是指以病毒、单纯疱疹病毒、细小病毒、痘病毒和 RNA 病毒(即反转录病毒)等外源目的的基因导入细胞内。
第四,目的基因的表达,即在重组基因上安装关键调控元件,如启动子、增强子,使整合到宿主的基因得到有效的表达,产生所需要的基因产物。
目前适合于基因治疗的疾病有遗传性疾病(如血友病、地中海贫血等)、免疫缺陷病、肿瘤、恶性血液病和糖尿病、心血管疾病等。
基因工程
根据基因的定义,基因本质上是核酸分子中的一段特定的序列,它包括编码蛋白质肽链或 RNA 的核酸序列,以及保证转录所必需的调控序列。不同种类的生物,其基因结构有所不同。随着分子生物学等学科的发展以及 DNA 分子克隆技术、核苷酸序列分析技术、核酸分子杂交技术等现代生物学实验手段的出现,使我们能够从分子水平上研究基因的结构与功能,并不断丰富与深化我们对基因本质的认识,为基因工程技术的应用奠定了坚实的理论基础。
DNA 重组技术一般文献中所说的基因克隆技术或重组 DNA 技术是指将一种生物体(供体)的基因与载体在体外进行产物或新性状的 DNA 体外操作程序。这其中,供体、受体、载体是重组 DNA 技术的三大基本元件。习惯上,基因克隆与基因工程含义相近,并未严格区分(文献中常用的其他同义词包括重组 DNA ,分子克隆,遗传工程等),但细分起来,这两个名称之间存在明显差别。基因克隆强调目的基因的克隆过程;而基因工程则着重于克隆工作的全局和整体。因此,基因工程是重组 DNA 技术的产业化设计与应用,包括上游技术和下游技术两大组成部分。上游技术指的是基因重组、克隆和表达的设计与构建;而下游技术则涉及基因工程菌或基因工程细胞的大规模培养以及基因产物的分离纯化过程。
综上所述,基因工程(genetic engineering)是指:利用重组技术,在体外通过人工“剪切”和“拼接”等方法,对各种生物的核酸(基因)进行改造和重新组合,然后导人微生物或真核细胞内进行无性繁殖,使重组基因在细胞内表达,产生出人类需要的基因产物。或者改造、创造新的生物类型。显然,基因工程操作中包含外源 DNA、载体分子、工具酶和受体细胞 4 个要素。
基本步骤基因工程技术自诞生以来已经取得了巨大的成就,特别是一些现代技术和先进仪器的不断涌现,进二步推动了基因工程技术的发展,但一个完整的、用于生产目的的基因工程技术程序包括的基本步骤有以下几个主要方面:
- 采用各种方法从复杂的生物体基因组中分离获得带有目的基因的 DNA 片段。
- 在体外,将带有目的基因的外源 DNA 片段连接到具有自我复制功能及筛选标记的载体分子上,构建成重组 DNA 分子。
- 将重组 DNA 分子转移到宿主细胞,并随宿主细胞的繁殖而扩增。
- 从细胞繁殖群体中筛选出获得了重组 DNA 分子的受体细胞克隆(称为重组子)。
- 从筛选出来的受体细胞中提取已经得到扩增的目的基因,以做进一步的分析鉴定。
- 将目的基因克隆到合适的表达载体上,导人宿主细胞,构建成高效、稳定的具有功能性表达能力的基因工程细胞,或转基因生物体系。
- 利用工程技术大规模培养上述的基因工程细胞,获得大量的外源基因表达产物,或选育和建立转基因新品系。
- 工程细胞表达产物的分离纯化,并最后获得所需的基因工程产品,或实验研究及推广应用转基因新品系。
上述 8 个步骤也可归并为两大部分,分属上游技术和下游技术。其中上游技术包括 1 ~ 5 ;下游技术包括 6 ~ 8 。两大部分有机结合成为一个整体:上游技术是基因克隆的核心与基础,上游设计中应以简化下游工艺和装备为指导思想;下游技术则是上游基因克隆蓝图的体现和保证,是克隆基因产业化的关键,两者必须兼顾,这是一个基本原则。
转录调节因子
真核生物的结构比原核生物复杂,所以真核生物的基因表达除了需要活化染色质,还需要活化基因,即转录水平的调节,而且转录水平的调控是真核生物基因表达调控中最关键的调控阶段。在转录水平的调节中,顺式作用元件和反式作用因下相互作用,共同控制着基因转录的起始和频率。
转录前水平的调控
顺式作用元件
顺式作用元件是真核生物细胞同一 DNA 分子中具有转录调节功能的特异 DNA 序列,主要指上游的调控区域内能与转录因子结合并影响基因转录的起始和频率的特异性 DNA 调控序列。按功能特性,真核基因顺式作用元件分为启动子、增强子及沉默子,起正调控作用的顺式作用元件主要包括启动子和增强子,起负调控作用的顺式作用元件主要指沉默子。
启动子
启动子是 RNA 聚合酶识别并结合的一段特异的 DNA 序列,是准确和有效地起始转录所必需的结构。真核生物有三种 RNA 聚合酶Ⅰ、Ⅱ、Ⅲ,它们分别负责rRNA、mRNA 和 tRNA 以及其他小分子 RNA 的转录。rRNA 的合成主要在核仁(nucleolus)进行,RNA 聚合酶 Ⅱ 与 Ⅲ 主要在核浆(nucleoplasm)中合成 RNA。通过对 RNA 聚合酶 Ⅱ 作用机制的研究发现,整个启动子是由近段的核心启动子和上游启动子元件(upstream promoter element,UPE)两个部分构成的。真核基因核心启动子包括转录的起始位点(initiator,Ior)和上游 -30~-25bp 处的 TATA 盒。起始位点的共有序列是 Py2CAPy5,即mRNA的第一个碱基通常为 A,左右有数个嘧啶。TATA 盒的核心共有序列是 TATAA,控制转录起始的准确性及频率。TATA 盒是基本转录因子 TFⅡD 的结合位点。实验证明,TATA 盒内单个碱基缺失或者突变,转录水平会大大下降。由 TATA 盒及转录起点即可构成最简单的启动子。除 TATA 盒外,GC 盒(GGGCGG)和 CAAT 盒(GCCAAT)也是很多基因常见的上游启动子元件,它们通常位于转录起点上游 -110~-30bp 区域。CAAT 盒的序列是 GGCCAATCT ,是转录因子 CTF/NF1 的结合位点。CAAT 盒对转录的效率十分重要,但并非所有的真核生物都有该序列。GC盒也并非所有的真核生物都有,它的全序列是 GGGGCGG,是转录因子 Sp1 等的结合位点,主要控制转录起始的频率,但它们都不参与起始位点的确定。有些 TATA 缺失(TATA less)的基因不含有 UPE,但常有下游启动子元件,位于 +28~+32bp。总结起来,Inr 和 TATA 盒主要决定转录的起始位点和方向,引起低水平的转录,而 UPE 能影响转录起始的频率,它通过和各种调控因子相结合,促进转录起始复合物的组装,提供转录起始的频率。
增强子
增强子(enhancer)是指远离转录起始点(1~30kb),增加同它连锁的基因转录频率的 DNA 序列。有效的增强子可以位于基因的 5′-端,也可位于基因的 3′-端,有的还可以位于基因的内含子中。增强子的效应很明显,一般能使基因转录频率增加 10~200 倍,有的甚至可以高达上千倍。增强子也是由若干机能组件组成,有些机能组件既可在增强子也可在启动子中出现。这些机能组件是特异转录因子结合 DNA 的核心序列。从机能上讲,没有增强子存在,启动子通常不能表现活性。没有启动子时,增强子也无法发挥作用。有时,对结构密切联系而无法区分的启动子、増强下样结构统称启动子。增强子发挥作用的方式与方向、距离无关,甚至远离靶基因达几百万碱基也仍有增强作用。
增强子的功能是可以累加的。缺失试验显示,SV40 增强子序列可以被分为两半,缺失一个并不产生什么影响,但如果两个均缺失即会大大降低活体内的转录。每一半序列本身作为增强子功能很弱,但合在一起,即使其中间插入一些别的序列,仍然是一个有效的增强子。因此,要使一个增强子失活,必须在多个位点上造成突变。
增强子能大大增强启动下的活性。增强子有两点有别于启动子:一是增强子对于启动子的位置不固定,而且有很大的变动;二是它能在两个方向产生作用一个增强子并不限于促进某一特殊启动子的转录,它能刺激在它附近的任一启动子。增强子的作用原理是什么? 增强子如何能在如此远的距离之外还能够增强基因的表达? 一种观点认为增强子为转录因子进入启动子区的位点提供帮助,提高了启动子附件转录因子的聚集度;第二种观点认为,增强子能改变染色质的构象,因为增强于区域容易发生从 B-DNA 到 A-DNA 的构象变化。
许多增强子的增强效应有很高的组织细胞专一性(tissue specificity),只有在特定的转录因子(蛋白质)参与下,才能发挥其功能。例如免疫球蛋白基因的增强子只有在 B淋巴细胞内活性才最高。除此以外,在胰岛素基因和胰凝乳蛋白酶基因的增强子中都发现有很强的组织特异性。此外,所有的增强子中均有一段由交替的嘧啶-嘌呤残基组成的 DNA,这种 DNA 极易形成 Z-DNA 型。故有人认为,在形成一小段 Z DNA 后,增强子才有功能。
增强子还受外部信号的调控,这种增强子的活性通常要有特定的启动子参与。例如,小鼠乳腺肿瘤病毒(MMTV)DNA 的转录可受糖类固醇激素的刺激。这个能受激素影响的顺序位于转录起点上游 100bp 处。此顺序可能和激素及其蛋白受体组成的复合物相结合。当将此顺序放在某基因的启动子的任二方向(上游或下游)和各种不同的距离时,它仍能刺激该基因的转录。因此,增强子还反映了瞬时调控(temporal regulation)的特性,其激活作用可能是:糖类固醇激素进入细胞后即与其受体结合。结合作用激活受体,使其能识别存在于增强子中的共同顺序,进而激活了在增强子附近能对糖类固醇起反应的基因。即当糖类固醇受体复合物和增强子结合时,其附近的启动子即起始转录。
沉默子
沉默子(silencers)是指某些基因含有的一种负性调节元件。当其结合特异蛋白因子时,对基因转录起阻遏作用。沉默子的 DNA 序列可被调控蛋白识别并结合,这样就阻断了转录起始复合物的形成和活化,关闭基因表达。沉默子最初是在酵母细胞中发现的。酵母细胞的 MAT 基因和 HMR、HNL 基因的启动子都存在于具有相同序列的 Y 区,但 MAT 基因可以转录,而 HMR、HML 基因却不能转录。缺失分析发现,在 HMR、HML 基因上游 -1kb 的位置存在沉默子,因此阻止这两个基因的转录。
基因座控制区
基因座控制区(locus control region,LCR)是染色体 DNA 上的一种顺式作用元件,结构域中含有多种反式作用因子的结合序列,可能参与蛋白质因子的协同作用,使启动子处于无组蛋白状态,增强相关基因的表达。如人类 β-球蛋白在转基因小鼠中的表达还需要 ε 基因 20kb 上游的一组顺式作用元件,这些元件对 DNaseⅠ 具有高度敏感性。同一 LCR 可以调控在不同染色体上的基因群表达,其原理尚不十分明了。
绝缘子
绝缘子(insulator)能阻止正调控或者负调控信号在染色体上的传递,阻断包括增强子、沉默子和 LCR 的作用,使染色质活性限制在一定结构域之内,它是一种中性的转录调节顺式元件。如果绝缘子位于增强子和启动子,只能作用于特定的启动子,防止增强子毫无选择地作用于任何启动干。相反,如果绝缘子位于活性基因和抑制因子之间,可以保护活性基因受抑制因子的作用而失活,绝缘子还可以阻断异染色质的扩散。
反式作用因子
大多数真核转录调节因子由某一基因表达后,可与另一基因上特异的顺式作用元件相互作用,从而激活或抑制另一基因的转录,这种调节蛋白称反式作用因子。反式作用因子的重要特点是编码反式作用因子的基因与被反式作用因子调控的靶序列(基因)不在同一染色体上。反式作用因子可被诱导合成,其活性也受多种因素的调节。反式作用因子在细胞中的数量很低,大约每个哺乳动物细胞中 10⁴ 左右。这些蛋白质识别特定的 8~15 个核苷酸序列,与 DNA 结合后,可以促进(正调控)或抑制(负调控)其邻近基因的转录。
反式作用因子具有三个基本特征:①一般具有三个功能结构域,包括 DNA 结合域、转录/抑制活性域和结合其他蛋白的结合域,它们是其发挥转录调控功能的必需结构,这些功能区含几十到几百个氨基酸;②能识别并结合基因调控区中的顺式作用元件;③对基因表达有正性和负性调控作用,即激活和阻遏基因的表达。
根据靶位点的特点反式作用因子可以分为4类:
- 通用反式作用因子,在一般细胞中普遍存在。通用转录因子是 RNA 聚合酶 Ⅱ 结合启动子时所必需的一组转录因子,所有的 mRNA 转录起始时通用。通用转录因子主要识别些 RNA 聚合酶 Ⅱ 启动子的核心成分 TATA 盒(如 TBP)、上游启动子成分 CAAT 盒(如 CTF/NF-1)、GC 盒(如 SPI),还可识别八聚体核苷酸的 Oct-1 等。
- 有的结合在增强子区或上游激活元件(upstream activation sequences,USAs),如甾体-受体复合物。USAs 是位于核心启动子上游的特异序列,控制转录起始的速率,是特异转录激活因子的结合位点。有的结合在沉默子并抑制特异转录,与增强子的主要区别是位于 TATA 盒下游时就没有功能。
- 辅助激活因子(coactivators),它们不与 DNA 结合,但是对于招募转录因子和转录起始复合物的组装是必不可少的。大多数转录因子并不与直接结合在核心启动子的通用转录因子相互作用,而是通过中间体辅助激活因子影响核心启动子的活性。辅助抑制因子(corepressors)介导抑制性反式作用因子的负性调控活性。
- 应答元件,如热休克应答元件(heat shock response element,HSE)、糖皮质激素应答元件(glucocorticoid response element,GRE)、金属应答元件(metal response element, MRE)、肿瘤诱导剂应答元件(tumorgenic agent response element,TRE)、血清应答元件(serum response element,SRE)等。应答元件为具有类似特点的一组基因共受二个转录因子调控的启动子或增强子元件,是启动子或增强子的上游元件,它们含有短的保守顺序。在不同的基因中应答元件拷贝数比较接近,但并不一定相同,离起始点的距离并不固定,一般位于上游小于 200bp 处,有的也可以位于启动子或增强子中。
真核生物的转录阻遏
一般来说,真核生物在转录水平的调控主要以正调控为主,而抑制作用主要通过控制染色质的结构实现。一些调节蛋白可作为转录抑制因子干扰 RNA 聚合酶和转录因子之间的相互作用,阻遏基因的表达。
真核生物的转录阻遏和原核生物类似,主要依赖于阻遏蛋白。这些阻遏蛋白的作用机理有以下几种:有些与特异的启动子元件结合以后,占据了激活蛋白的作用位点,阻止了转录前起始复合物的组装;有些作为转录因子或辅助激活因子的抑制蛋白,拮抗它们的转录激活功能;有些结合在启动子的下游,阻止 RNA 聚合酶的转录。因此,真核生物转录水平的调控对细胞活性的影响也是正调控和负调控平衡作用的结果。
实验显示,有的转录因子具有双重功能。例如,糖皮质激素受体,一方面与特异的 DNA 序列结合后可以激活类固醇激素相关基因的转录,另一方面也能够与另一个相关基因的 DNA 特异位点相结合,抑制其转录。
固醇类激素对基因转录的调控
激素对基因调控作用的轮廓是激素-受体-作用位点,三者缺一不可。固醇类激素受体成员包括雌激素受体、雄激素受体、视黄酸受体、糖皮质和盐皮质激素受体、甲状腺激素受体、维生素D 受体。固醇类激素受体属于核受体(nuclear receptor,NR)超家族的重要成员。目前核受体超家族已有 49 个基因和 75 个以上核受体蛋白。核受体为依赖配体的转录因子,对转录的调控涉及以下几个方面:① NR 与基因组内的特异性调节位点相结合;② 以配体依赖的方式招募共转录激活因子,修饰染色质及其相关蛋白;③ 调节 RNA 聚合酶矼在启动子的结合与功能;④ 终止或削弱 NR 依赖的信号转导。固醇类激素受体通过对基因转录的调控影响生长、增殖、分化等细胞生命活动的方方面面。
固醇类激素受体对基因转录的调控
固醇类受体蛋白常常先和配基结合被活化。脂溶性的固醇类激素可以通过自由扩散透过细胞膜,与细胞质中的受体特异性地结合。当固醇类受体与激素结合后,受体蛋白将发生结构变化而被激活,活化的激素-受体复合物进入核内,与特异的 DNA 相结合,启动靶基因的转录。靶基因上激素-受体复合物特异性结合的 DNA 序列,即激素应答元件 HRE,常常起到增强子的作用。
受体蛋白和配基结合后,形成二聚体。活化的激素-受体复合物本身并不能促进基因转录,它必须和其他转录因子协同作用才能促进转录。受核受体调节的基因,其启动子部位除有 HRE、TATA 盒外,还有多个其他转录因干的结合位点。
与相应激素结合后,糖皮质激素受体或孕激素受体与 HRE 结合促使染色质结构发生改声,其启动子部位出现 DNaseⅠ 高敏区。在染色质结构改变过程中,组蛋白乙酰化导致核小体解聚可能是一个关键步骤。染色质结构改变使染色质由非活性状态向活性状态转变,并允许 NF1 等转录因子结合到 DNA 上,可能也使 TFⅡD 易于结合到 TATA 盒上而形成稳定的转录起始前复合物,从而促进基因转录。
一些固醇类受体(如 TR)在配体缺失的情况下,可直接与 DNA 结合,招募负调控因子,通过去乙酰化等机制抑制转录基本装置的功能。糖皮质激素受体(GR)介导的负调控则需要糖皮质激素的作用,结合特定的负调控 GRE,通过对抗其他转录因子的活性,竟争性耗竭激活因子等机理来抑制转录活性。
转录后水平的调控
在真核细胞中,基因转录的最初产物称核内不均一 RNA,经过剪切、拼接、带帽和加尾等加工过程,才能形成成熟的 mRNA。具体操作过程可参考相关书籍。
