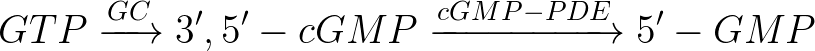蛋白酪氨酸磷酸化是细胞用来调控信号转导的一个最主要的手段。在细胞内,酪氨酸磷酸化是同一个动力学可逆的过程,并且该磷酸化过程可以抑制蛋白酪氨酸激酶( PTKs )的活性。PTKs 是用来催化酪氨酸磷酸化,而 PTPs 控制着去磷酸化过程。因此, PTKs、PTPs 及它们相应的底物都属于可调节信号转导的一类化合物,它们在体内的细胞生长、分化、代谢、细胞周期、细胞闻通讯、细胞迁移等这些基本活动中起着极为重要的信号转导调节作用。这一信号转导网的缺陷和不适当则会导致酪氨酸磷酸化的异常,进而引发许多人类疾病如癌症和糖尿病等。
PTPs 也可以被划分为三大类,即特异性酪氨酸 PTPs(tyrosine-specific)、双重特异性 PTPs(dual-specific)和低分子量的 PTPs 。特异性酪氨酸 PTPs 和低分子量的 PTPs 目标物必须是含有酪氨酸的蛋白,而双重特异性的 PTPs 目标物既可以是含有酪氨酸的蛋白,也可以是含有丝氨酸和苏氨酸的蛋白。一些双重特异性的PTPs可以水解底物而不是水解磷酸蛋白。双重特异性的 PTPs 包括 MAP 激酶磷酸酶(MKPs),细胞循环调节器 Cdc25 磷酸酶和肿瘤下扰抑制器 PTEN 。许多疾病都与信号转导有障碍有关,其特征就是酪氨酸磷酸化过度或者不能正常实现磷酸化。
酪氨酸磷酸酯(pTyr)模拟化合物的设计是发现 PTPs 抑制剂的一条最主要途径。在早期, pTyr 模拟化合物的设计主要是针对 PTPs 的催化活性区域,通常用磷酸、乙酸、丙二酸、磺酸和草酸等来代替磷酸酯基,因为所有的 PTPs 都拥有相同的磷酸化的酪氨酸活性位点,所以设计单一的、选择性的 PTPs 的抑制剂;而独特的与 PTP 活性位点相临近的部位能够作为靶点增强抑制剂的亲和力和选择性。基于此原理,人们已经发展了几种有效的选择性好的 PTPs 抑制剂。
无机化合物抑制剂
最早发现的一类可逆的非特异性 PTPs 抑制剂是钒酸盐和过氧钒酸盐。其中钒酸盐能竟争性抑制活性位点中的半胱氨酸残基。在钒酸盐与 PTP1B 复合物的晶体结构中,钒原子与活性位点中的硫醇非常靠近,并与酶形成三角双锥形的过渡态结构,类似于磷酰基转移过程中形成的硫代磷酸盐过渡态。 PTPs 包含一个具有催化功能的半胱氨酸残基,因此一些碱性试剂和氧化试剂可能成为潜在的 PTPs 抑制剂。过氧钒酸盐则为一种强氧化试剂,它使活性位点中的半胱氨酸残基氧化成为磺酸,因此它对 PTPs 的选择性要强于钒酸盐;其他的无机类 PTP 抑制剂还有一氧化氮和苯胂化氧;这些无机化合物除了可以抑制 PTPs 外,还有其他的酶抑制活性,正是这种非专一性限制了其作为药物的可能性。
磷酸酯类抑制剂
磷酸酯类化合物具有较强的抑制活性、一直作为 PTPs 抑制剂设计的重点。在磷酸的 a 位引入负电性的卤原子后,降低了磷酸根的 \(pK_{a}\) 值,增强了磷酸与 PTPs 催化活性区域的静电作用及氢键相互作用。拥有两个 DFMP 结构单元抑制剂分别与催化活性区及第二结合位点作用,其活性是单二氟亚甲基磷酸(DFMP)化合物的 450 倍,并且对 PTP1B 有一定的选择性。为了构建分子多样性的化合物库,采用平行合成技术,以不同的肽模拟物片段连接两个二氟亚甲基磷酸结构单元,筛选得到的化合物对 PTP1B 具有很高的亲和力。
噻二唑烷酮类抑制剂
噻二唑烷酮类是一类直接针对胰岛素抵抗的新药,该类药物通过增加靶器官内的胰岛素敏感性来改善血糖控制。该类化合物是酪氨酸磷酸酯的生物电子等排体。磷酸酯中的两个氧原子与砜基上的氧配适,而磷酸酯中的第 3 个氧原子与 2 位氮原子重叠。由于 1 位砜基和 3 位羰基均为吸电子基团,2 位氮上的质子具有弱酸性,可以模拟磷酸酯与催化活性区的碱性氨基酸形成静电作用,增加与酶的亲和力。噻二唑烷酮类抑制剂的开发为 pTyr 模拟物设计提供了一条新思路,有望成为高活性、高选择性、药学性质适合的新药物。